"ТЕОРИЯ И ПРАКТИКА ОЗДОРОВИТЕЛЬНОГО ДЫХАНИЯ"
Под ред. д.м.н., проф. Цирельникова Н. И.
СОДЕРЖАНИЕ
 1.
Теоретические основы оздоровительного дыхания.
1.
Теоретические основы оздоровительного дыхания.
ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ
ОЗДОРОВИТЕЛЬНОГО ДЫХАНИЯ
В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Цирельников Н. И.
Доктор медицинских наук, профессор - руководитель отдела
Научного Центра клинической и экспериментальной медицины
СО РАМН, Новосибирск
С давних пор человек понимал, что основной функцией организма,
благодаря которой лимитируется его жизнедеятельность, является дыхание. Известно,
что процесс дыхания контролируется целым набором физиологических механизмов,
которые через систему хемо- и барорецепторов, центральную и периферическую нервную
систему реализуют процесс взаимодействия легочного и сердечно-сосудистого коллекторов,
включая в этот контур, практически все органы и ткани организма - кроветворения,
эндокринные железы, водно-солевого обмена и желудочно-кишечного тракта, кожу
и ткани внутренней среды, мышцы и опорно-двигательный аппарат.
Согласно полученным нами данным, контролируя различные фазы
дыхательного акта, можно существенным образом оптимизировать внутриклеточный
метаболизм конкретных органов и, таким образом, не только улучшать состояние
организма и повышать функциональные параметры органов и систем, но и активировать
защитные свойства клеток, обеспечивая немедикаментозное восстановление органов
и тканей, вовлеченных в патологический процесс.
Используя различные вариации дыхательного акта, врачи Индии,
Тибета, Китая сотни и тысячи лет назад успешно лечили многие хронические заболевания,
прекрасно понимая физиологию организма как целого и роль органов дыхания при
этом. Расчленив человека на многие составляющие, сначала на системы - пищеварительная,
дыхательная, сердечно-сосудистая и др., затем на ткани и органы, затем на клетки
и внеклеточное вещество, затем на внутриклеточные органеллы и молекулярный уровень,
мы потеряли человека в целом. Медицина из холистической, т. е. целостной, превратилась
в медицину различных органов и тканей. И то, что ранее удавалось врачам в далеком
прошлом, сегодня представляется непреодолимым препятствием - я имею в виду лечение
хронических заболеваний. Сегодня уже среди новорожденных выделяется определенный
процент больных детей, и к году постнатальной жизни более 1/3 из них имеют диагноз
хронического заболевания.
Обладая прекрасным терапевтическим эффектом в период острого
течения патологического процесса, лекарственные препараты нередко становятся
причиной хронизации разных заболеваний, и во многих случаях человек практически
попадает в полную зависимость от них. Я считаю, что величайшая роль Лео Кофлера,
О. Г. Лобановой, Е. Я. Поповой, Е. А. Лукьяновой, А. Н. Стрельниковой, К.П.
Бутейко и многих других ярких представителей оздоровительного дыхания не в том,
что они разработали различные методы дыхательной терапии при целом ряде заболеваний,
а в том, что они одни из первых, без использования каких-либо лекарственных
препаратов, показали возможность применения дыхательных упражнений для лечения
таких грозных заболеваний, какими являются туберкулез, астма или обструктивные
процессы легких, отметив при этом позитивные результаты и при других нелегочных
заболеваниях. Целая плеяда прекрасных отечественных разработчиков использования
дыхательной терапии (А. Н. Стрельникова, Ю. Г. Вилунас, Ю. Б. Буланов, О. Ю.
Ермолаев и др.), в том числе и медицинских работников, отметила хороший терапевтический
эффект применения дыхательных упражнений при самых различных заболеваниях, включая
патологию сердечно-сосудистой системы, эндокринных органов, крови, желудочно-кишечного
тракта, центральной и периферической нервной системы, опорно-двигательного аппарата
и т. д.
Восстановление правильного дыхания является одним из основных
методов оздоровления организма. Мы понимаем сегодня, что если неправильно питаться,
то возникнут заболевания органов желудочно-кишечного тракта, если неправильно
сидеть, то это приведет к патологии позвоночника, громкий и резкий звук отражается
на физиологии органов слуха, а плохое освещение или повышенные нагрузки при
чтении являются основой патологии органов зрения и т. д. То же самое можно сказать
и о неправильном дыхании, несоблюдение физиологии которого является причиной
развития многих заболеваний и не только органов дыхания. Если выстроить цепочку
причинно-следственных отношений, то можно увидеть картину развития патологического
процесса практически любого органа или ткани. К примеру, затруднение дыхания
в силу различных причин вызывает нагрузку на правое сердце, которое после непродолжительного
усиления декомпенсируется, приводя к застойным явлениям и гипоксии. Последняя
активирует синтез эритропоэтина и кроветворение. Стресс, сопровождаемый гипоксией,
приводит к выбросу кортикостероидов, снижению иммунитета и активности противовоспалительной
реакции, появлению язвенной болезни и гастродуоденита и т. д., и т. п.
В последние годы стали появляться аппаратные методы дыхательных
упражнений, преимущество которых заключается в возможности строгой регламентации
и дозирования дыхательных нагрузок. Среди которых можно выделить следующие действующие
факторы:
а) сопротивление дыханию на вдохе и выдохе,
б) гипоксия и гипероксия,
в) гиперкапния и гипокапния,
г) возможность ингаляции и увлажнение воздуха.
По силе и направленности эффекта контролируемое дыхание можно
сравнить лишь с пищевым воздействием, т.е. воздействием через желудочно-кишечный
тракт. Однако простота процедуры, широкий диапазон регламентации и контроля
отдают приоритет дыхательному оздоровлению, учитывая, кроме того, отсутствие,
практически, противопоказаний и совместимость с любыми другими методами лекарственной
и нелекарственной терапии.
В настоящей статье предложен базовый материал развития и физиологии
газотранспортной и "нереспираторной" функции легких, позволяющий врачам,
в первом приближении понять роль легких в сложном ансамбле систем, органов и
тканей человеческого организма.
Действительно, дыхание является самой важной функцией в жизни
человека и млекопитающих, так как на протяжении долгого пути эволюции высшие
организмы, в принципе, потеряли возможность депонировать кислород. Если без
пищи млекопитающие могут прожить достаточно долго - 30 и более дней, без воды
2-3 дня, то без кислорода необратимые изменения в клетках мозга наступают уже
через 5-7 минут.
Кислород начал появляться на земле около 2 милиардов лет назад
и первые живые существа, примитивные формы жизни были анаэробами, т. е. живущими
в безкислородной среде. Считается, что митохондрии, использующие кислород для
получения энергии у современных клеток, представляли собой отдельную живую структуру,
которая была симбиотически ассимилирована в цитоплазму эволюционирующих в то
время клеточных форм жизни, прошедших с ними весь путь коэволюции. И чем выше
по эволюционной лестнице формировался вид, тем больше он зависел от содержания
кислорода в окружающей среде, и тем больше он терял способность выживать при
пониженных концентрациях кислорода. Млекопитающие только на эмбриональном этапе
развития или в период зимней спячки сохранили относительную устойчивость к пониженным
концентрациям кислорода.
В покое организм человека за 1 минуту потребляет 250 мл кислорода
и образует 200 мл углекислого газа. Органы и ткани используют неодинаковое количество
кислорода в покое и при нагрузке (таблица 1 и 2).
Таблица 1
Потребление органами человека кислорода в мл на I кг веса в
минуту
________________________________________________________
Органы и ткани В
покое При
напряженной деятельности
_________________________________________________________
ЖКТ________________35.0 __________________350.0
Сердце_____________18.0___________________36.0
Почка______________85.0___________________840.0
Печень_____________15.2___________________50.0
Слюнная железа_____40.0___________________160.0
Мышцы_____________4.0____________________32.0
_________________________________________________________
Таблица 2
Потребление кислорода на грамм сырого веса в минуту различными
тканями по Thews (1963 - Цит. по Райский. 1970)
_____________________________________________
Кровь________________________0.03 мл/мин/100 гр
Скелетная мышца (в покое)______0.2
Мозг_________________________3.3
Печень_______________________4.5
Почка________________________5.5
Сердце (в покое)_______________10.0
В этой таблице хорошо виден ранг потребления,
в то время как чувствительность клеток тех или иных органов к понижению кислорода
располагается в другой последовательности, где на первом месте по наименьшей
резистентности стоит кора головного мозга, затем почки и т. д. Запасов кислорода
в организме нетренированного человека (1.5-2 0 л) хватает всего на 5-7 минут.
По данным Леви и Цунтца легкие могут обеспечить проникновение
в кровь человека 6080 мл кислорода в минуту, в то время как в покое человек
потребляет всего 250 мл, при нагрузке - 3000-4000 мл, то есть, как мы видим,
легкие вполне справляются со своей задачей в условиях функционирования менее
10 процентов ткани.
Каждый грамм гемоглобина может присоединить 1,34 мл кислорода,
а учитывая, что в норме содержится 14,5 - 16 гр Нв на 100 мл крови, то в 100
мл крови может содержаться 19-21 мл кислорода. Количество кислорода и углекислого
газа в различных элементах и сосудах легких представлено в таблице 3.
Таблица 3
_________________________________________________________________________
Парциальное давление мм pт. ст. (или абс. %) Кислорода
Углекислоты
в воздухе____________________________________152,0 - 159,0___________0,23
(20 95 об %)
в альвеолах легких ___________________________100,0 - 107,0___________38,3 -
40,00
в артериальной крови_________________________100,0 - 85,0____________45,0 -
50,0
(19 00 абс %)
в тканевой жидкости__________________________0 - 20_________________40,0 - 60,0
в венозной крови_____________________________40 - 50_________________55,0 -
60,0
(14 00 абс %) (4 5 абс %)
артерио-венозная разница для
большинства тканей составляет_______________4 - 6 абс %______________10 абс
% _____________________________________________________________________________
В природе интенсивный газообмен может происходить не только
через легкие. Выведение углекислого газа у лягушки осуществляется через кожу
и составляет примерно 85 процентов, т. е. значительно больше чем через легкие.
Через кожу, в основном, также идет и насыщение крови кислородом на протяжении
большей части жизни. У человека на долю кожного дыхания приходится 1.9 % поступившего
кислорода и 2.7% выделившейся углекислоты. В период внутриутробного развития
кислород к плоду поступает по довольно сложной цепи: кислород воздуха - альвеолы
легких - эритроциты матери - плацента - эритроциты плода - органы и ткани плода.
Известно, что в эмбриональном состоянии некоторые животные также обходятся поверхностным
дыханием, так как сердечно-сосудистая система у них развивается намного раньше,
чем легкие. То же самое можно сказать и о раннем внутриутробном этапе развития
"еловека.
Некоторые ныряющие млекопитающие и во взрослом состоянии обладают
удивительной способностью длительно находиться в безвоздушной среде:
Тюлень....................- 15 мин
Ондатра..................- 12 мин
Кит-полосатик........- 30 мин
Кашалот..................- 90 мин
(Для сравнения: человек 1.0-2.0 мин и 7-9 мин специально тренированный).
Как показали исследования, длительное нахождение этих животных
под водой обусловлено развитием целого комплекса физиологических механизмов
- способностью мозга, мышц и сердца переносить кислородное голодание, относительно
малой чувствительностью тканей к накоплению СО2 и молочной кислоты, способностью
замедлять ритм сердца (тюлень - от 80 уд в мин до 10 уд в мин), повышать эффективность
двигательной функции мышц (Проссер Л., Браун Ф., 1967) при пониженной концентрации
кислорода в крови.
У пойкилотермных животных окислительный обмен снижается например
при их акклиматизации к низким температурам и меньшим концентрациям кислорода.
Млекопитающие в процессе зимней спячки (ежы и др.) переносят значительное снижение
кислорода в течение нескольких часов, хотя в нормальном состоянии быстро погибают
при том же снижении концентрации кислорода в окружающем воздухе. Как в процессе
ныряния, так и в процессе зимней спячки ткани животных менее чувствительны к
недостатку кислорода (Проссер Л., Браун Ф.1967). Опыты с яйцами морского ежа,
сердечной мышцей млекопитающих и дрожжами показали, что система цитохромов в
клетке выдерживает понижение РО2 вплоть до 2,5 об.%, в норме эта величина составляет
19 абс.%, т. е. до 13 процентов от обычно обеспечиваемой величины. Подобный
факт свидетельствует об уровне биологической защиты тканей от случайных или
иных понижений концентрации кислорода в крови, притекающей к органу.
Образуемый в тканях углекислый газ поступает в эритроциты
и с помощью фермента карбоангидразы переходит в угольную кислоту, диссоциирующей
на HCOj и НГ. Кроме растворения небольшого количества в плазме и тканевой жидкости,
СО2 образует соли с катионами, в основном бикарбонаты, соединяясь с водой, СО2
образует угольную кислоту (СО2 + + Н2О = Н2СО3), которая связывается буферными
системами (в основном с белками). Поступая с током крови в легкие, СО2 диффундирует
в альвеолярный воздух, так как концентрация его в воздушной среде почти на порядок
ниже, чем в крови.
Гибель клеток при низком напряжении кислорода в среде наступает,
по-видимому, из-за недостаточного количества образуемой энергии для поддержания
нормальной физиологии и молекулярной структуры клеток и их мембран. Однако чрезмерно
повышенное содержание кислорода в тканях также является токсичным. Если куколки
перепончатокрылого Habrobracon в течение 1 часа находились при 1 атм О2 или
в течение 5 мин при 2 атм, это приводит к цитологическим повреждением и снижению
обмена у вылетевших взрослых особей. Давление О2 в несколько атмосфер может
быть токсичным для млекопитающих, пребывание мышей в течение 5 часов при 6 атм
вызывает их гибель. Токсичность может быть снижена введением восстанавливающих
агентов - глютатиона и цистеина, что свидетельствует об образовании большого
количества радикалов и перекисей. Дегидрогеназы янтарной и пировиноградной кислот
и триозо-дегидрогеназы также ингибируются высоким количеством кислорода.
В то время как каталаза и другие гемсодержащие ферменты, т. е. системы, участвующие
в метаболизме кислорода, а также флавопротеиды, дегидрогеназы молочной и яблочной
кислоты при этом не страдают. Чувствительные к повышенному количеству кислорода
ферменты, как правило, имеют активные SH-группы. Следует отметить, что у всех
животных имеются ферменты для анаэробного гликолитического обмена. Некоторые
животные ведут анаэробный образ жизни, другие нуждаются в небольшом количестве
кислорода, но гликолиз у них остается основным видом обмена, несмотря на присутствие
в среде кислорода. Многие животные могут переходить на анаэробный путь метаболизма
лишь на непродолжительное время.
Большое значение для нас имеет работа А. В. Войно-Ясинецкого
(1958), который, изучив у ряда представителей кольчатых червей, членистоногих,
круглоротых рыб, земноводных и млекопитающих тоскичность высоких давлений кислорода,
показал, что общей закономерностью является последовательное выключение филогенетически
молодых функциональных систем с одновременным высвобождением более старых систем
центральной нервной системы, функционирующих на более ранних этапах филогенеза.
То же самое можно сказать и по отношению к гипоксии (или гиперкапнии), когда
в организме может происходить переключение регуляторно-метаболических систем
на древние филогенетические пути, являющихся более устойчивыми к повреждающему
фактору.
РАЗВИТИЕ, ДИФФЕРЕНЦИРОВКА И СТАНОВЛЕНИЕ ФУНКЦИИ ЛЕГОЧНОЙ ТКАНИ
Чтобы понять физиологию легочной ткани, необходимо познакомиться
с особенностями эмбрионального развития легких в процессе раннего (внутриутробного)
развития. Первым признаком, свидетельствующим о начале образования легких, является
появление ларинго-трахеальной бороздки в задней части глотки на 24 день развития
эмбриона, которая тянется по середине вентральной части первичной кишки. Углубляясь,
эта бороздка отделяется от вентральной кишки почти на всем своем протяжении
за исключением краниальной части. Возникнувший таким образом зачаток формирует
трахею параллельно пищеводу. Позднее, в месте соединения формируется голосовая
щель. Из зачатка вентральной части кишки формируется только эпителий, выстилающий
трахею и хрящи, соединительная ткань и мышцы формируются из окружающей ее мезенхимы.
После удлинения трахеи до определенной длины к 26-28 дню, конец ее раздваивается
и образует две легочные почки, которые растут, разветвляются, образуя бронхиальное
дерево. Если удалить мезенхиму, то ветвление бронхов не происходит. При этом
трахеальная мезодерма способствует формированию трахеи, а легочная - формированию
разветвления и если их поменять местами, то ничего не получится. Здесь достаточно
наглядно демонстрируется пример межтканевых взаимодействий, определяющий впоследствии
физиологию легочной ткани, особенно в условиях патологического процесса.
Из энтодермы формируется эпителий, выстилающий бронхи, их
железы и альвеолярные мешочки. Плевра легких возникает из спланхнотической мезодермы.
К 6-й неделе внутриутробного развития формируются сегментарные
бронхи, а к 12 неделе устанавливаются очертания основных долей легких. Респираторные
бронхи дифференцируются приблизительно к 16 неделе, из них к 24 неделе формируются
альвеолярные мешочки. В момент рождения их размеры значительно меньше и они
менее глубокие, чем у младенца в 1-2-месячном возрасте.
Тем временем капилляры дифференцируются из окружающей мезенхимы,
начиная с 20 недели развития и к 26-28 неделе капилляры вступают в непосредственную
связь со стенками альвеолярных мешочков, формируя т. н. альвеолярные мембраны,
однако лежащая между ними ткань представляет собой плотный барьер. Особенно
следует отметить, что только к 26-28 неделе внутриутробного развития становится
возможным внеутробный газообмен при условии, что общая поверхность легких окажется
достаточной. Подобные временные несоответствия, обусловленные спецификой предшествующего
эволюционного процесса, нередко являются причиной внутриутробного формирования
целого ряда изменений, ведущих к развитию заболеваний в послеродовом развитии
в условиях воздействия на этот процесс различных негативных факторов (лекарственных
препаратов, перенесенных в течение внутриутробного развития, инфекций, эндокринно-метаболических
нарушений и т. д.).
Альвеолярные мембраны состоят их альвеолоцитов первого и второго
типа. Функция клеток I типа обеспечивает основную массу газообмена, альвеолоциты
II типа обладают способностью продуцировать сурфактант. Альвеолоциты III типа
описаны под названием щеточных клеток, отличаются наличием коротких микроворсин
на апикальной поверхности, наличием многочисленных везикул в цитоплазме и пучком
микрофибрил.
Кровоснабжение легких осуществляется из бронхиальной и легочной
артерий, первая оканчивается на уровне бронхиол, впадающих в ацинусы, в то время
как легочная артерия снабжает в основном альвеолярные мешочки, т. е. обеспечивая
собственно газообмен, далее кровь из посткапиллярных сосудов попадает в легочные
вены. Между ветвями системы легочной и бронхиальной артерий и вен имеются анастомозы,
функция которых регулируется замыкательными артериями. Особенно следует отметить,
что лимфатических капилляров в системе ацинуса (альвеолоцитов) не обнаружено.
Легкие плода наполнены не амниотической жидкостью, как считают
многие, а жидкостью, напоминающей плазму крови, выделяемой легочными тканями,
хотя содержание белка составляет всего 300 мг%, в 20 раз меньше, чем в плазме
крови. У человека поверхностно-активные вещества - лецитин и сфингомиэлин формируются
с 26 недели беременности. Однако в достаточном количестве они начинают образовываться
только с 34-36 недели беременности. Дыхательные движения плода можно зарегистрировать
уже на 13-14 неделе беременности, частота которых варьирует от 3 до 70 дыхательных
движений в минуту. Диабет женщин, гипертония и токсикоз беременных сопровождаются
снижением частоты дыхательных движений плода.
Постнатальный рост легких представляет собой энергичный активный
процесс. В младенчестве происходит быстрое увеличение окружности грудной клетки,
в основном из-за увеличения количества альвеол и респираторных бронхиол. У новорожденного
имеется 24 млн. альвеол, к 3-месячному возрасту их становится 77 млн., у взрослого
человека количество альвеол достигает величины 300 млн. и более. Альвеолярные
мешочки у родившихся детей значительно меньше по размеру, диаметр их составляет
50 мкм по сравнению с детьми более старшего возраста, где их размер 100-200
мкм, достигая 200-300 мкм у взрослых. Площадь поверхности, на которой происходит
газообмен, у взрослого человека в 20 раз больше чем у новорожденного, что приблизительно
соответствует превышению массы взрослого человека над массой новорожденного.
Морфометрические показатели легочной ткани взрослого человека
составляют:
а) дыхательная поверхность легких (по Эбби ).....- 80-90 кв. м.,
б) диаметр альвеол (по Кунтцу).............................. - 0.2 мм
в) поверхность альвеол............................................ - 0.126 кв.
см.
г) число альвеол ....................................................... - 450-725
млн.
Площадь капиллярного русла в легких у взрослых занимает 35-40
кв, м. Капилляры представлены двумя типами клеток - широкими, диаметром 4-12
мк и узкими 2-4 мк. Существование в малом круге артериовенозных анастомозов
является главной причиной анатомического шунтирования крови. Среднее время прохождения
крови через малый круг является 4,5-5 сек. В состоянии покоя у человека в легких
содержится около 500 мл крови, из них только 80-120 мл (всего 20-25 % объема
легочной крови) в альвеолярных капиллярах. Остальная кровь распределяется в
магистральных, крупных, средних и мелких сосудах.
Шунтирование крови через невентилируемые (контролируемо вентилируемые)
альвеолы, так же как и избыточная вентиляция недостаточно кровоснабжаемых альвеол,
снижает поступление кислорода к органам и тканям при видимой эффективности работы
всей системы внешнего дыхания и сердечно-сосудистой системы. То есть - вентиляция,
диффузия и легочный кровоток, это три последовательных звена в цепи переноса
газов в системе внешнего дыхания, и вместе с тем это три неразрывно связанных
механизма системы, обеспечивающие ее деятельность и получение конечного результата.
Грамотное использование оздоровительного дыхания позволяет существенным образом
влиять на специфику физиологии органов и тканей, обеспечивающих этот механизм.
РЕГУЛЯЦИЯ ДЫХАНИЯ
При необходимости резко усилить дыхание млекопитающие прибегают
к гипервентиляции легких. В инспираторных нейронах дыхательного центра возникает
первичный нервный импульс, который передается на диафрагму и межреберную мускулатуру,
сокращение которых расширяет объем фудной клетки и действует подобно насосу
в момент забора воздуха. Одновременно расширение легких вызывает поток сенсорных
импульсов передаваемых в мозг по блуждающему нерву. Это ведет к торможению активности
инспираторных нервных центров. При спокойном дыхании выдох - процесс обычно
пассивный, но он может быть и активным, как и активно контролируемым. Центры
- вдоха, выдоха и пневмотоксический тонический центр находятся в тесном взаимодействии.
Наиболее тонкая регуляции деятельности дыхательного механизма осуществляется
концентрацией углекислоты в крови, которая является прямым стимулятором дыхательного
центра, но в определенных условиях этим же действием обладает и понижение рН
крови. Возбуждение дыхательного центра осуществляется также и через рецепторы
каротидных синусов, чувствительных к снижению концентрации кислорода в крови,
которые при гипоксемии посылают импульсы к дыхательному центру. Это происходит
когда содержание кислорода в крови снижается до 100 мм рт ст. Наконец, повышение
СО2 в крови выше 30 мм рт. ст. стимулирует каротидный синус. Учитывая это, основной
задачей дыхательных упражнений на первом этапе является снижение порога возбудимости
хеморецепторов при повышении в крови концентрации углекислого газа, закисления
рН и падения содержания кислорода (оксигемоглобина).
ИННЕРВАЦИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ И ЛЕГКИХ
Трахея, бронхи и легкие иннервируются вегетативной нервной
системой. Следует различать афферентную и эфферентную вагусную, эфферентную
симпатическую иннервацию (Netter F. Н., 1982), причем влияние парасимпатической
иннервации на бронхи в норме выражено сильнее, чем симпатической. Афферентные
волокна начинаются от "рецепторов раздражения" в слизистой оболочке
гортани, трахеи и бронхов и от рецепторов, воспринимающих растяжение в стенках
альвеол. "Рецепторы раздражения", участвующие в осуществлении кашлевого
рефлекса, обнаружены между клетками в покровном эпителии дыхательных путей.
В межальвеолярных перегородках В. Ф. Лашков (1975) находил рецепторы трех типов.
Рецепторы, воспринимающие растяжение альвеол, участвуют в регуляции ритма и
амплитуды дыхательных движений. Чувствительные окончания обнаружены также в
стенках легочных артерий и ее ветвей. Считается, что они воспринимают механические
и, вероятно, химические раздражения. Значительная часть афферентных волокон
в составе блуждающего нерва направляются к чувствительным клеткам узловатого
ганглия, другая часть - к звездчатому ганглию, к нижним шейным и верхним грудным,
а иногда, к расположенным более каудально спинальным ганглиям (Лашков В. Ф.,
1975).
Эфферентные вагусные волокна начинаются в основном от клеток
дорсальных ядер в продолговатом мозге. В нервных сплетениях бронхов они сменяются
короткими постганглионарными волокнами, несущими импульсы к мышцам и железам
трахеи, бронхов и бронхиол, а также и к сосудам. Вагусная иннервация относится
к холинергической и вызывает сокращение гладких мышц дыхательных путей, секрецию
желез и расширение сосудов.
Эфферентные симпатические волокна начинаются в спинном мозге
на уровне от 1-2 и до 5-6 грудного сегмента. Волокна, иннервирующие гортань
и верхнюю часть трахеи, переключаются на постганглионарные в верхнем шейном
симпатическом узле. Волокна, несущие импульсы к каудальному отделу трахеи, бронхам
и бронхиолам, переключаются в верхних грудных ганглиях пограничного симпатического
ствола. Они направляются в легочные сплетения и являются адренергическими. Раздражение
симпатического нерва вызывает расслабление мускулатуры бронхов и бронхиол, торможение
секреции желез и сужение сосудов. Однако рецепторы неоднородны: различают альфа-
и бета-рецепторы и среди последних бета-1 и бета-2 рецепторы. В легких имеются
альфа- и бета-2 рецепторы: бета-стимуляция приводит к расслаблению мышц, расширению
просвета бронхов и кровеносных сосудов, понижению секреции. Альфа-стимуляция,
напротив, вызывает сокращение бронхов и сосудов.
Иннервация легких находится под контролем гипоталямическаго
влияния и коры головного мозга, что обеспечивает интегра-цию дыхания и функцию
других органов и систем, а также двойную - автоматическую и произвольную регуляцию
дыхания. В эксперименте как холинергические, так и симпатические альфа- и бета-агонисты
стимулируют выделение трахеобронхиального секрета (Jeffery P. К., 1983), как
после денервации, так и в опыте инвитро, что свидетельствует о наличии спонтанной
активности клеток парасимпатических ганглиев, иннервируюших субмукозные железы.
У здоровых людей бронхиальную секрецию стимулируют симпатомиметики и глюкокортикоиды,
тогда как атропин обладает подавляющим действием.
Иннервация воздухоносных путей осуществляется парасимпатическим
и симпатическим отделами нервной системы. В покое тонус бронхиального дерева
определяется холинергической регуляцией. Значение симпатической иннервации в
воздухоносных путях спорно, хотя доказано снабжение симпатическими волокнами
сосудистой системы и бронхов. Например, электрическая стимуляция симпатических
нервов не может снять бронхоспазм, вызванный стимуляцией блуждающего нерва.
Одним из вероятных путей адренергической регуляции дыхания является интеграция
импульсов от рецепторов бронхиального дерева и каротидного синуса на уровне
ствола мозга с последующей стимуляцией выброса катехоламинов мозговым веществом
надпочечника (в основном адреналина).
Кроме того, высказывается мнение о модулирующем действии симпатических
волокон на уровне парасимпатических ганглиев в стенках бронхов. В последние
годы выделяют неадренергическую, нехолинергическую, а пуринергическую - ингибирующую
нервную систему. Аксоны этой системы характеризуются наличием больших гранул,
содержащих моноамины (серотонин и 5-гидроксидофамин), а в качестве медиатора,
по мнению авторов, выступает АТФ. Кроме того, основным нейротранс-миттером пуринергической
нервной системы является вазоактивный интестинальный пептид - ВИП (Barnes P.
J., Dixon С., 1984), снимающий констрикцию бронхов, вызванную гистамином. Стимуляция
ирритантных рецепторов кроме кашлевого рефлекса вызывает увеличение продукции
и клиренс слизи в респираторном тракте, снижение растяжимости легких.
Стимуляция барорецепторов вызывает рефлекторное снижение тонуса
сосудосуживающего центра и повышение тонуса ядер блуждающего нерва, в результате
чего снижается артериальное давление. Факт, нередко используемый для снятия
гипертензии с помощью дыхательных упражнений.
Физиологическая роль катехоламинов (адреналина) опосредуется
клеточными рецепторами двух типов - альфа и бета. Первые хорошо взаимодействуют
с адреналином и норадреналином, но не связываются или слабо взаимодействуют
с изопротеронолом. В последние годы выделили два подтипа альфа-рецепторов, различающихся
по степени сродства к аденилатциклазе (Hofrman R. А., 1980).
Различают также два типа бета-рецепторов: бета-1, расположенные
в сердечной мышце и бета-2, локализованные в стенках кровеносных сосудов и бронхов,
механизм действия которых опосредуется, в основном, через активацию аденилатциклазы.
В норме наблюдается бронходилатируюшее действие катехоламинов (адреналина) через
бета-2 рецепторы гладкой мускуларутры. Вызывая увеличение цАМФ, адреналин повышает
устойчивость тучных клеток и базофилов к дегрануляции, предотвращает выделение
медиаторов бронхоспазма - гистамина и МРС-А и др. Гистамин образуется из Л-гистидина
при помощи фермента гистидиндекарбоксилазы в лаброцитах и базофилах. Установлено,
что стимулирующее действие адреналина на выделение гистамина реализуется через
альфа-рецепторы, а блокирующее - через бета-рецепторы, атропин блокирует этот
процесс. Острая гипоксия стимулирует высвобождение гистамина и накопление его
в легочной ткани. Реакция бронхолегочного аппарата на введение гистамина является
одним из наиболее характерных признаков патологической реактивности бронхов,
т. к. внутривенное введение гистамина здоровым людям, даже в токсической дозе
не вызывает реакцию легких. Установлено, что Н-1 рецепторы осуществляют бронхоконстрикцию
в ответ на введение гистамина, а Н-2 - бронходилятацию (Eister N. М., et al.,
1981). Блокатор Н-1 рецепторов хлорфениламин значительно уменьшал бронхоконстрикторное
действие гистамина. В то же время реализация бронходилататорного действия гистамина
отмечалось только у больных с бронхиальной астмой.
В 1977 году J. Orehek с соавт. предложил метод выявления изменения
чувствительности и реактивности бронхов. Под чувствительностью они понимали
ту минимальную дозу бронхосуживающего агента, которая приводила к уменьшению
объема форсированного выдоха в сек (ОФВ1) на 20%. Повышенная чувствительность
к ацетилхолину и гистамину нередко выявлялась у одних и тех же больных бронхиальной
астмой, введение атропина блокировало эту реакцию, что свидетельствовало о роли
блуждающего нерва в генезе бронхоспазма.
Нарушение равновесия между симпатической и парасимпатической
отделами регуляции, развивающееся при целом ряде нелегочных заболеваний, может
привести к развитию бронхоспазма, так как приступ удушья. У морских свинок развивается
при повреждении симпатического отдела гипоталямуса. Дисфункция гипоталамуса,
проявляемая вегетативными кризами, также нередко сопровождается бронхоспазмом.
Длительный гиперкортицизм, развиваемый в результате болезни, приводит к нарушению
гипоталамо-гипофизарно-надпочечникового дисбаланса в результате повышения резистентности
рецепторов гипоталамуса к кортикостероидам, что регистрируется по малому "дексаметазоновому
тесту", в результате блокады бета-адренорецепторов.
При нарушении баланса между прогестероном и эстрогенами также
могут наблюдаться приступы удушья. Что выявляется у мужчин (повышение суммарных
эстрогенов) и у женщин при нарушении баланса прогестерон-эстрогены. Важное значение
имеет и гормон щитовидной железы, так как он обладает эффектом разобщать окислительное
фосфорилирование и нарушать образование циклических нуклеотидов, субстратом
для которых является АТФ.
Кроме газообмена легкие выполняют в организме роль фильтра,
задерживая из циркулирующей крови различного рода микроэмболы - микроагрегаты
крови, оторвавшиеся тромбы, газовые и жировые эмболы и т. д. Величина среднего
давления в малом круге равна 15 мм рт. ст., в то время как в большом круге -
90 мм рт. ст. Известно, что при использовании нитратов и других сосудорасширяющих
препаратов можно добиться полного или частичного устранения легочной гипертензии,
однако, при этом оксигенация крови уменьшается за счет восстановления кровотока
через невентилируемые или мало вентилируемые участки легочной ткани и соответственного
ухудшения вентиляционно-перфузионных отношений (Сильвестров В. П. и др., 1985).
Данный факт, кроме того, свидетельствует о том, что в норме у человека функционирует,
в основном, часть легочной ткани, обусловленная, в том числе, снижением вентиляции
в определенном проценте альвеол (как, кстати, и в любом другом органе).
Одним из важнейших путей организации вторичных медиаторов
является арахидоновый метаболизм - арахидоновая кислота, метаболизируясь в двух
циклах - липооксигеназном и циклоокигеназном, является источником лейкотриенов
и простагландинов (ПГ) разного типа, бронхоконстрикторное действие которых в
4000-6000 раз превосходит гистамин. Кроме того они вызывают отек и секрецию
слизи за счет повышения посткапиллярной венозной проницаемости. Циклооксигеназный
путь является источником ПГ и тромбоксанов разного типа с неодинаковыми биологическими
эффектами, таких как бронходилятационный (ПГЕ2) и бронхоконстрикторный (ПГФ2)
с хемотаксической активностью.
Продукты липоокигеназного метаболизма арахидоновой кислоты,
лейкотриены, при аллергических реакциях, а моногидроэкозаеновая кислота при
аспириновой астме являются стимуляторами трахеобронхиальной секреции. Скорость
эвакуации секрета усиливается после ингаляции в трахею ацетилхолина и гистамина,
атропин - замедляет, а адренергические вещества - ускоряют. Медленно реагирующая
субстанция анафилаксии (МРС-А) вызывает уменьшение скорости выведения секрета,
а простаглан-дины ПГЕ1, ПГЕ2 и лейкотриен С4 - усиливают активность ресничек.
Полученные данные позволяют предположить, что при хроническом бронхите избыток
слизи реабсорбируется реснитчатыми клетками путем эндоцитоза и транспортируется
в лизосомы для последующего разрушения.
Арахидоновая кислота является предшественником многих биологически
активных веществ (БАВ), при циклооксигеназном пути метаболизма из нее образуется
ПГ, тромбоксаны, простациклины, при липооксигеназном пути - лейкотриены, производные
эйкозотетраеновой кислоты, к которым относится и МРС-А (медленно реагирующая
субстанция анафилаксии - Petterson N. A. et al., 1981). Помимо лаброцитов (тучных
клеток) возможностью к синтезу МРС-А обладают нейтрофилы, моноциты и макрофаги.
Кроме того, арахидоновая кислота, образуемая из фофсолипидного комплекса клеточных
мембран под воздействием фосфолипазы, являются субстратом для синтеза ПГ, при
этом ПГЕ, в большей степени формируется тканью бронхов, а ПГФ - паренхимой легких
(Gardiner P. JL, Collier H., 1980).
ПГЕ-2 оказывает выраженное бронходилатирующее, а ПГФ-2-альфа
- бронхоконстрикторное действие. Чувствительность к ПГФ-2-альфа у больных бронхиальной
астмой примерно в 8000 раз выше, чем у здоровых, а к гистамину только в 10 раз.
Гистамин вызывает высвобождение ПГФ при действие через Н-1 рецепторы, а ПГЕ
через Н-2 рецепторы. Эффект ПГ осуществляется в основном в периферических бронхах
через специальные рецепторы, т. к. не блокируется ингибиторами к рецепторам
адреналина, гистамина, ацетилхолина, и серотонина.
Лейкотриены также обладают в 30-300 раз более выраженным действием
чем гистамин. Фосфодиэстераза, инактивирующая циклазы, активируется при участии
кальцийсвязывающего термостабильного белка (кальмодулина). Вначале кальмодулин
связывается с кальцием, а затем активирует фосфодиэстеразу, образуя комплекс
кальмодулин - ФДЭ-Са.
ФАКТОРЫ НЕСПЕЦИФИЧЕСКОЙ МИКРОБИЦИДНОЙ АКТИВНОСТИ
К неспецифическим факторам защиты можно отнести - лизоцим,
лактоферрин, интерферон, пирогены, неспецифические ингибиторы, протеолитическую
и антипротео-литическую системы легких. Лизоцим секретируется сегментоядерными
лейкоцитами, нейтрофилами, альвеолярными макрофагами и серозными клетками бронхиальных
желез. Противобактериальное его действие заключается в расщеплении бактериальных
глико-
заминогликанов, после чего клетки приобретают форму шара и становятся нежизнеспо-собными.
Особенно чувствительны к этому воздействию грамм-положительные бактерии. Образующиеся
при этом гликопептиды стимулируют митотическую активность лимфоцитов, продукцию
антител и защитные реакции ГЧЗТ.
У детей первых двух лет жизни отмечается низкое содержание
лизоцима в секрете бронхов. Лактоферрин связывает железо бактерий, недостаток
которого является фактором хронизации воспалительного процесса в бронхах. Макрофаги
и лимфоциты синтезируют интерферон, действующий, практически, на все вирусы,
так как ограничивает их размножение. Эндогенные пирогены активируют термореакцию
и способствуют усилению синтеза интерферона, инактивацию зрелых вибрионов. В
последние годы в секрете бронхов обнаружено большое количество аскорбиновой
кислоты, которая, обладая сильным окислительным эффектом, защищают бронхи и
легкие от озона, атмосферного кислорода и других активных примесей и эндогенных
субстратов. Гранулоциты бронхиального секрета выделяют огромное количество протеаз
- эластазу, коллагеназу, химотрипсин подобный фермент. Макрофаги секретируют
большое количество кислых катепсинов. Однако, при большом количестве данных
биологически активных веществ, может повреждаться и собственная стенка бронхов.
Функцию защиты от этого воздействия берет на себя альфа-1-антитрипсин, синтезируемый
слизистой оболочкой бронхов. В настоящее время выделено три типа ингибиторов:
альфа-1-АНТ, антихимотрипсин, антритромбин-111 и альфа-2-макроглобулин, которые
ингибируют активность лейкоцитарной коллагеназы, кроме того, при этом может
формироваться адренергический дисбаланс.
Дефицит альфа-1-антитрипсина (АНТ) встречается у 0.9 % людей,
у больных с ХНЗЛ он встречается почти в 10% случаев. Альвеолярные макрофаги
секретируют лизосомальное содержимое - кислые и нейтральные гидролазы, продукты
арахидонового метаболизма, ПГ и тромбоксаны, которые, являясь местным гормоном,
модулируют активность гладких мышц бронхов, бронхиальную секрецию и проницаемость
сосудистой стенки. Кроме того, они обладают способностью выделять в окружающую
среду активные метаболиты кислорода - супероксид-анион, способствующий изменению
функции клеток эндотелия легких в отношении метаболизма серотонина, брадикинина
и ангиотензина. Учитывая, что эти клетки очень чувствительны к действию свободных
радикалов, нарушение захвата сосудоактивных аминов вызывает выраженные расстройства
микроциркуляции. Примером является повреждение легких при т. н. респираторном
дистресссиндроме взрослых (шоковое легкое), обусловленное прогрессирующим диффузным
отеком респираторной части легкого. По результатам исследований с культурой
клеток эндотелия легочных капилляров, наиболее ранней фазой патологического
процесса является способность лейкоцитов к адгезии с внутренней мембраной эндотелиальной
клетки. Агрегированные нейтрофилы при контакте с клеткой, которую они не способны
поглотить, превращаются в секретирующие и выбрасывают содержимое лизосомальных
органелл - гидролазы (эластазу) и метаболиты кислорода со свойствами свободных
радикалов, которые и оказывают выраженное токсическое действие на эндотелиальные
клетки. Ранним критерием повреждения служит снижение способности захвата последними
серотонина и брадикинина. Протекторным действием, при этом, обладают каталаза
и супер-оксиддисмутаза.
Генерацию активных супероксидных радикалов производят и эозинофилы,
так же как и синтез лизофосфолипазы, которая, кристаллизуясь, превращается в
кристаллы Шарко-Лейдена, обнаруживаемые при гипер-эозинофильных легочных реакциях.
Кроме того, в эозинофилах содержится пероксидаза, сходная с миэлопироксидазой
нейтрофилов, обладающая значительной эффективностью против кандида. Кроме того
эозинофил может дегранулировать лаброциты.
Макрофаги выделяют ангиотензинконвертазу, превращающую ангиотензин-1
в ангиотезин-2, кроме того они синтезируют плазминоген. Нейтрофилы работают
больше при недостатке кислорода (гипоксия и ацидоз) - синтезируя миэлопироксидазу,
лизоцим, лактоферрин, и неферментные катионные белки. Чем можно объяснить позитивный
эффект гипоксической тренировки на уровень иммунной защиты организма. Катионный
белок эозинофилов повышается при острой пневмонии, остром инфаркте, эозинопении
в периферической крови. Вещества типа азидов, ингибирующие эозинофильную периоксидазу,
усиливают продукцию эозинофилами МПС-А. Концентрация тучных клеток в легких
- от 1 до 7 млн на грамм ткани. Лаброциты секретируют большое количество биологически
активных веществ (БАВ) - гистамин, серотонин, хемотаксиче-ские факторы - тетрапептид
для эозинофилов, олигопептид для нейтрофилов и эозинофилов, фактор активации
тромбоцитов, калликреин, протеиназу с трипсиноподобным эффектом. Первичные медиаторы
в тучных клектах синтезируются постоянно, а вторичные - в процессе стимуляции.
Первичные - гистамин, серотонин и хемотоксичные факторы тетрапептид, с хемотоксическими
для эозинофилов свойствами. Некоторые авторы относят к первичным медиаторам
- фактор активации тромбоцитов, калликреин, а также протеиназу с трипсиноподобным
и действием. Гистамин увеличивает тонус бронхов и уменьшает бронхиальную проходимость
при сокращении гладких мышц, подавляет выделение лимфокинов лимфоцитами, лизосомальных
ферментов -нейтрофилами и макрофагами, стимулирует пролиферацию фибробластов,
участвует в привлечении в очаг воспаления эозинофилов.
Функцию защиты от чрезмерной протеолитической активности выполняют
ингибиторы протеаз, главным из которых на уровне альвеол является альфа-1-антитрипсин
(АНТ). а в бронхах и верхних дыхательньщ путях - низкомолекулярный кислотостабильный
ингибитор, которых сегодня выделено три, синтезируемые слизистой бронхов (Johnson
D. A. et al, 1982). Агенты, повышающие уровень цАМФ (теофилин, изопротеронол,
ПГ), обычно ингибируют выброс лизосомальных ферментов из МКФ (макрофаги периферической
крови). Однако ингибирующий эффект в альвеолярных макрофагах значительно ослаблен,
что обусловлено меньшей плотностью адрено- и ПГ-рецепторов. Рецепторы к Fc-фрагменту
IgG и третьему компоненту комплемента в АМКФ представлены достаточно полно,
что дает клетке возможность распознать опсонизированнные бактерии, а затем осуществлять
прилипание и фагоцитоз последних.
Легкие, в силу необходимости контактировать с внешней средой,
подвергаются воздействию различных, в том числе и негативных, факторов, природного
или техногенного происхождения.
1) Легкие представляют собой наиболее крупную биологическую мембрану,
внешняя поверхность которой постоянно контактирует с кислородом, в первую очередь,
являющимся источником свободных радикалов в виде супероксиданиона и гидроперикиси,
а также с такими активными инцициаторами свободно-радикального окисления, как
озон и диоксид азота - наиболее распространенными примесями современной атмосферы.
Аэрогематический барьер этой мембраны обеспечивается, главным образом, структурной
организацией липидов.
2) В ткани легких, характеризующейся большой интенсивностью липидного
обмена, происходит синтез липидных компонентов сурфактанта, синтез и инактивация
продуктов арахидонового метаболизма.
3) В реализации защитных механизмов антиинфекционной направленности
большое значение имеют метаболиты кислорода со свободно-радикальными свойствами,
выделяемые фагоцитами, а при защите от биологических веществ чужеродного происхождения
(ксенобиотики) в системе их микросомального окисления.
4) В действии на клетки легких многих профессиональных факторов
и привычных токсических продуктов (табачный дым), в настоящее время, ведущая
роль отводится активации ПОЛ.
На молекулярном уровне наиболее выраженное антиоксидантное
действие оказывают сами липиды, способные к присоединению свободных электронов
в цепях ненасыщенных жирных кислот. Клетка способна избавляться от образующихся
липоперикисей путем экзоцитоза. В мембране "тушителями" свободных
электронов выступают сероводородсодержащие вещества: тиолы, убихинон, токоферол,
(витамин Е).
В клетке ключевое защитное значение имеет фермент супероксидисмутаза
(СОД), катализирующая превращение супероксиданиона в менее активный пероксид
водорода, который расщепляется каталазой, препятствует образованию гидроксильного
радикала. Большое значение в антиоксидантной системе имеет система ферментов,
образующая восстановленный глютатион. Повышение концентрации свободных радикалов
приводит к изменению активности в обмене углеводов и в частности - гексозо-монофосфатного
пути тесно связанного с формированием восстановленного глютатиона.
Церулогшазмин также относится к активной системе внеклеточной
антиоксидантной защиты, как и многие стероидные гормоны. К мощным системам антиоксидантной
защиты относится гемоглобин - при этом повышение количества метгемоглобина можно
рассматривать как защитную реакцию против гипероксического повреждения тканей.
Возникновение адренергического дисбаланса т. е. уменьшение
бетта-адренерги-ческих антивоспалительных эффектов, с одновременным усилением
альфа-адренерги-ческих реакций, тесно связано с нарастанием свободно-радикальных
процессов и характерно для аллергических заболеваний легких (влияние на цАМФ
и обмен кальция).
РЕГЕНЕРАЦИЯ
Эпителиальные клетки в ротоглотке обновляются в течение 3
дней, в бронхиолах - 8-9 недель, альвеолоциты второго типа - на протяжении от
1 до 4-5 недель. В эпителии трахеи период обновления клеток для пласта в целом
составляет 11-12 недель, однако имеется популяция клеток с периодом обновления
в 2-3 дня. В трахеи и бронхах реснитчатые клетки перед делением утрачивают реснички,
бокаловидные клетки теряют секреторные гранулы. Митозы встречаются на разном
уровне эпителиального пласта, но чаще всего в базальном слое. В результате образуется
ложномногослойный эпителий, который в дальнейшем, в зависимости от условий,
вновь дифференцируется в исходный многорядный мерцательный или метаплазируется
в многослойный плоский. Как правило, заживление повреждений, за исключением
мелких и поверхностных, происходит по типу субституции - без восстановления
утраченной части легкого, и функциональная компенсация осуществляется за счет
оставшихся частей, которые подвергаются регенераторной гипертрофии.
Метаплазия бронхиального эпителия в многослойный плоский наблюдается
в условиях воспаления, регенерации, авитаминоза А и малигнизации. Частой формой
метаплазии в легких является эктопическое образование костной ткани в хрящевых
пластинках бронхов, у пожилых людей в связи с дистрофическим обизвествлением,
а у молодых людей и детей - при бронхоэктазах и хроническом воспалении бронхов.
При этом происходит трансформация хондробластов в остеоциты, а между новообразованными
костными балками нередко развивается кроветворение.
НЕРЕСПИРАТОРНАЯ ФУНКЦИЯ ЛЕГКИХ
Впервые термин "нереспираторные функции легких"
появился в литературе в 1969 году (J. Vane), куда прежде всего автор отнес ряд
функций по регуляции уровня некоторых веществ циркулирующих в крови, где наиболее
важной является ингибирование вазоактивных компонентов крови.
1. Из биогенных аминов легкие наиболее интенсивно инактивируют серотонин.
В экспериментах на изолированных легких собаки показано, что 98% амина может
инактивироваться, при этом сначала происходит его поглощение и депонирование,
а затем метаболизация путем окислительного дезаминирования моноаминооксидазой
(МАО) с образованием 5-гидроксииндолуксусной кислоты, и путем метилирования
с образованием мелатонина. В легких МАО представлена двумя формами: МАО-А -
дезаминирует серотонин и норадреналин, МАО-В - фенилэтиламин и бензиламин (Youdim
M. et al., 1980). Известно, что тромбоциты также депонируют большое количество
серотонина, кроме того, он может метаболизироваться и в печени, однако функция
легочной ткани в этом плане является преобладающей.
2. 40% норадреналина метаболизируется в эндотелиальных клетках легких
митохондриальной МАО типа А.
3. Инактивация ацетилхолина органами дыхания показана в опытах с
перфузированными легкими при введение больших доз медиатора (100- 200 мг).
4. В легких обнаружена мощная система, разрушающая брадикинин, представленная
пептидилдипептидазой (ПДП), активность которой в легких в 10 раз выше, чем в
сердечной мышце. Известно, что 80% брадикинина разрушается при однократном прохождении
через легкие.
5. Доказано, что очищенные ферменты из легочной ткани могут гидролизовать
брадикинин и участвовать в превращении ангиотензина 1 в ангиотензин 11, что
обеспечивается отщеплением 1 -гистидилдейцина под действие ПДП, которую чаще
называют кининазой-11 или ангиотензин-конвертирующим ферментом. Даже при введении
в легочную артерию ангиотензина 1 в 10 000 превышающих физиологическую, более
половины этого вещества превращается в ангиотензин-11 за один круг циркуляции.
Введение в перфузат брадикининпотенцирующего фактора (БПФ) ингибирует гидролиз
бракинина и конвертирование ангиотензина. В настоящее время известны 9 пептидов,
ответственных за биологическую активность БПФ, однако, наиболее активным ингибитором
ПДП является каптокрил.
6. Кроме того субстратами для ПДП являются также энкефалин и инсулин.
7. Легкие являются основным органом, инактивирующим ПГ, так как
95% групп Е и Ф инактивируется при введение их в венозную кровь в концентрации
0.5-1 мг/л. окислением гидроксильной группы у 15 углеродного атома простагландиндегидрогеназой,
в результате чего образуются неактивные метаболиты, подвергающиеся дальнейшей
деструкции в печеночной ткани. Кроме того, может происходить метаболизм ПГ путем
конъюгации их с глютатионом.
Имеются данные, свидетельствующие о том, что метаболизм биогенных
аминов и ацетихолина меняется в процессе течки у самок крыс. Известно, что вдыхание
дыма не влияет на метаболизм серотонина, в то время как метаболизм ангиотензина
и ПГЕ2 существенно нарушается. Пребывание в атмосфере с повышенной концентрацией
кислорода (97%) в течение 18 часов значительно снижает метаболизм моноаминов
и ПГ в перфузированных легких за счет снижения активности МАО. Оксид азота,
галотан или гипотермия снижают активность легких ингибировать моноамины, что
приводит к увеличению в крови серотонина и норадреналина. Первоначальное воздействие
гипоксии вызывает увеличение активности МАО, в то время как повторная гипоксия
значительно снижает активность фермента. Также влияет, и острый воспалительный
процесс в легких, вызывая активацию МАО, длительное хроническое заболевание
является причиной угнетения фермента. При бронхиальной астме отмечается усиление
образования и накопление кининов, которое обусловлено интенсификацией перехода
прекаллекриина в каллекриин (судя по количеству образования брадикинина), снижение
кининазной и ингибиторной активности крови.
8. Легкие играют важную роль в поддержании агрегатного состояния
крови. Установлено, что легкие являются источником синтеза факторов свертывания,
таких как тромбопластин, факторов VII и VIII антисвертывающих субстанций, таких
как гепарин. Легкие, наряду с плацентой и мозговой тканью, являются источником
получения тромбопластина, который образуется в эндотелии и эпителии легких.
Легочная ткань, контролирует концентрацию тромбопластина - то снижая, то повышая
его количество в крови, протекающей через них. Кроме того легочная ткань, синтезируя
активатор гшазминогена, обеспечивает переход плазминогена в плазмин, поддерживая
таким образом его концентрацию в крови и обеспечивая оптимальный уровень фибринолиза.
В частности найдена корреляция между кининогенезом, выраженностью гиперкоагуляции
и степенью фибринолиза у больных с бронхиальной астмой. При воспалительных процессах
в легких возникает множество микротромбов в мелких кровеносных сосудах легких,
способствующих прогрессированию бронхолегочного процесса, как правило, являющееся
следствием усиления адгезии и агрегации тромбоцитов под влиянием БАВ легочной
ткани. В связи & этим в крови повышается концентрация тканевых медиаторов
- биогенных аминов, ацетилхолина, кининов, сочетающееся с внутрисосудистым свертыванием
в системе легочной циркуляции.
9. Основными источниками энергии в легких являются липиды, липо-протеиды,
жирные кислоты, глюкоза и ее метаболиты, поступающие с током крови. Еще полвека
назад было показано, что кормление животных жирной пищей приводит к подъему
уровня липидов в притекающей к легким крови и снижению их содержания в крови,
оттекающей от легких. При этом большая часть липидов подвергается распаду, а
энергия беттаокисления идет на образование фосфолипидов клеточных мембран и
легочного сурфактанта, синтез ПГ и других соединений.
Другим основным субстратом является глюкоза, гликоген и молочная
кислота. Глюкоза метаболизируется, в основном, в аэробных условиях с образованием
значительных количеств АТФ и выделением СО2. Распад ее идет, как правило, по
гликолитическому пути, хотя и не исключена возможность пентозофосфатного пути
метаболизма.
10. К нереспираторным функциям следует отнести также и способность
легких к кондиционированию вдыхаемого воздуха, так как температура воздуха в
альвеолах равна температуре крови, при этом отмечается максимальная его влажность,
максимально адекватная для прохождения газообмена. В экспериментах показано,
что вдыхание воздуха охлажденного до -55 градусов Цельсия не изменяло температуры
воздуха в альвеолах. Более того, температура крови, оттекающая от легких оказалась
на 0.2 градуса выше, чем в притекающей крови.
Кондиционирующая функция легких нарушается при гипоксии,
вызванная излишним повышением концентрации СО2, сдвигом рН в кислую сторону,
возрастанием лактата в крови, снижением активности карбоангидразы, что способствует
ослаблению связи белков с жирными кислотами. Кроме того, холодовая экспозиция
вызывает увеличение метаболизма адреналина в легких на 64%, а в условиях хронической
гипоксии на 114%. Нарушение кондиционирующей функции легких наблюдается у больных
с ХНЗЛ и бронхиальной астмой и может служить важным диагностическим показателем.
Учитывая, что нереспираторные функции легких тесно связаны
с основной функцией газообмена, детальное изучение отдельных сторон указанных
характеристик может способствовать уточнению патогенетических аспектов легочных
заболеваний при ранней диагностике, определении эффективности лечения, прогноза
течения и в профилактике патологии легких.
БИОЛОГИЧЕСКИЕ РИТМЫ В ФИЗИОЛОГИИ ЛЕГКИХ
Известны ритмические изменения, которые претерпевают показатели
функции внешнего дыхания, включают колебания бронхиальной проходимости, легочных
объемов, вентиляции и газообмена. Циркадные ритмы бронхиальной проходимости
характеризуются снижением в ночное время и повышением в дневное. Чаще всего
суточный ритм калибра дыхательных путей характеризуется вариабельностью пиковой
скорости потока (ПСП). По данным M.R.Hetzel (1984) более 60% здоровых лиц обнаруживали
достоверный суточный ритм ПСП с акрофазами (максимальная функция параметра)
от 13 до 17 часов и батифазами (минимальная функция параметра) от 3 до 5 часов.
У взрослых наблюдается отчетливая динамика проходимости мелких бронхов с ухудшением
в ранние утренние часы и улучшением днем, а у детей - крупных бронхов с оптимальным
состоянием проходимости в ранние утренние часы, что объясняется различиями в
функциональной активности симпатико-адреналовой системы. Кроме циркадных, имеются
ультрадианные ритмы с периодом менее суток и несколькими акрофазами в период
от 8 до 12 часов и батифазами в 16 и 4 часа. Недельный ритм ПСП с акрофазой
на 7 и батифазой на 4 день предположительно связывают с влиянием глюкокортикоидов.
Изменения ритма ЖЕЛ наблюдается в 8 ч., затем величина снижается к 16 часам
и остается на этом уровне до 4 часов утра. Ритм показателей структуры общей
емкости легких (ОЕЛ) является высокодостоверным, особенно для ООЛ и опережает
изменения показателей проходимости бронхов. При астме, обструктивных процессах
в легких отмечаются значительные смещения ритмов изменения легочных показателей.
Ритмы показателей вентиляции и газообмена - минутный объем
дыхания (МОД) и частота дыхания (ЧД) у здоровых людей уменьшаются в ночное время
с повышением Ра СО2. Акрофаза синхронизируется с активностью поглошения кислорода
и выделением СО2 в 16 часов, в это же время и отмечается максимальная физическая
работоспособность. ДЛ снижается в период с 9.30 до 21.30. Выявляется фазовый
сдвиг ритмов показателей проходимости центральных и периферических бронхов,
диффузионная способность легких (ДЛ), жизненная емкость легких (ЖЕЛ), остаточный
объем легких (ООЛ) и РаО2. У больных астмой наблюдается жесткая синхронизация
всех показателей и совпадение их по времени со значительным ухушением параметров
в 4 и 8 часов, что сопровождается приступами удушья. Вполне естественно, что
синхронизация ритмов легких определяется многими экзо- и эндогенными факторами,
среди которых называют суточный ритм гипофизарно-надпочечниковой системой. Наблюдается
совпадение фаз ритмов кортизола, экскреции 17-корти-костероидов и показателей
бронхиальной проходимости, легочной вентиляции и газообмена, порога чувствительности
к ацетилхолину, гистамину и количеству эозинофилов в крови. Ритм бронхиальной
проходимости определяется автономным влиянием симпатического тонуса днем и парасимпатического
- ночью.
Циркадную ритмичность изменения функции внешнего дыхания необходимо
учитывать при выборе времени и метода дыхательных упражнений, как и другой медикаментозной
терапии, а нормализацию функциональных данных и их ритмичности, следует считать
критерием эффективности лечения (Федосеева Г. Б., Синицина Т. М., 1989).
Учитывая ведущую роль нейро-эндокринных регуляций в обеспечении
взаимодействия межтканевых и межсистемных корреляций роль нарушения связей в
центральной нервной системе имеет большое значение в появлении различных недугов,
в том числе и в поражении многих органов и систем. По данным Захаржевского В.
Б. (1986) изменение функционального состояния высших интегративных центров закономерно
уже в латентном периоде невроза ("предневроз"), проявляется нарушением
межсистемной корреляцией, включая соотношение кровоснабжения и cпецифической
(разрядка наша) функции органа. Среди непосредственных механизмов этого феномена
называются ослабление нисходящего влияния неокортекса на ретикулярную формацию
ствола мозга, усиление сходства деятельности различных мозговых структур (стереотипия),
повышенная склонность к генерализации возбуждения. Свойственная неврохаотичность
деятельности корковых элементов (повышенная вариабельность, лабильность или
инертность, фазовые состояния, волновобразность) через изменение состояния высших
подкорковых центров находит отражение и в базальных характеристиках сердечно-сосудистой
системы и в характере ее ответов на различные воздействия. Дальнейшее углубление
невротических расстройств функций ССС обеспечивается формированием застойных
очагов возбуждения, приобретающих доминантный характер, изменением соотношения
нейромедиаторных систем в сторону преобладания симпатоадреналовой, вовлечением
гормональных механизмов стрессорной реакции, изменением механизмов гормональной
рецепции и интерроцептивной сигнализации, формированием "порочных кругов".
В связи с этим следует отметить хороший позитивный эффект дыхательных упражнений
на восстановление нарушенных связей в центральной и периферической нервной системе.
Устойчивые нарушения функций, к примеру, кровообращения с
потерей адаптивности циркуляторных ответов, свидетельствующее о глубоком подавлении
механизмов саморегуляции и, как правило, ограничивающееся рамками одной висцеральной
системы, выявляются только при определенных условиях. В основе подобной избирательности
могут лежать генетически детерминированные нейрохимические отличия или особенности
нейроэндокринных ответов. Так, у павианов гамадрилов при неврозе чаще поражается
ССС (гипертония, коронарная недостаточность), а у макаков-резусов пищеварительная
система, у крыс линии Август преимущественно развивается гипертензия, у крыс
линии Вистар - повреждение слизистой оболочки желудка (Беллер и др., 1980).
К избирательности невротического повреждения могут приводить
и соответствующие воздействия на данную систему в раннем постнатальном онтогенезе.
Так, применение у крысят ангиотензина и электрошоковых стимулов обеспечивало
развитие у взрослых животных стойкой гипертензии (Беллер и др., 1980). Определенная
избирательность поражения сердечно-сосудистой системы может создаваться и непосредственным
подключением ее собственных механизмов регуляции в конфликтной ситуации. Так,
у обезьян искусственное переключение натуральной двигательной активности на
стресс длительной иммобилизацией вызывало развитие выраженных коронарных нарушений
(Репин, Старцев, 1975). Перенапряжение центральных механизмов регуляции кровообращения
создается при сшибке условных рефлексов, выработанных на основе стимуляции рецепторных
полей сердца и сосудов, или непосредственно соответствующих кортикальных зон
(Суворов, 1967; Захаржевский, 1979).
Преимущественная направленность невротизирующего воздействия
может создаваться острым или хроническим повреждением данной системы или относительно
компенсированными следами такого воздействия. Так, осуществление сшибки на фоне
компенсированных последствий перевязки венечной артерии приводило к выявлению
экстрасистол, изменению зубца Т, смещению интервала S-T; комбинация стрессорных
нагрузок с супрессорной сенсибилизацией ангиотензином вызывало у макак-резусов
развитие артериальной гипертензии; "расшатывание" механизмов регуляции
сосудистого тонуса с помощью инъекций эфедрина облегчало формирование у собак
невротической гипертензии; локальное изменение механизмов адренорецепции в зоне
имплантации сосудистого датчика способствовало развитию у собак, после сшибок,
неадаптивных коронарных констрикторных реакций (Захаржевский, 1979; Беллер и
др., 1980).
Таким образом, механизм избирательности может формироваться
как на периферии (создание местного очага ирритации), так в центральных образованиях
(парциональное вовлечение в конфликную ситуацию центров регуляции системы или
органа). Однако избирательность локализации внешнего проявления отнють не означает
признания локальности самого невроза, на определенных этапах неизбежно принимающего
генерализованный характер.
С другой стороны, тренировочные упражнения, особенно развивающие
устойчивость к гипоксии, направленные на развитие адаптивных реакций в этой
системе, могут стабилизировать межсистемные взаимоотношения как в пределах высшей
нервной деятельности, так и внутри других систем (сердечно-сосудистой, пищеварительной,
выделительной и пр.), а также межсистемных корреляций.
Анализ литературы и наши собственные наблюдения показали,
что дыхательные упражнения обладают важным тренирующим действием на клетки и
ткани всего организма, обеспечивая формирование санирующего эффекта при наличии
болезненных процессов, повышению резистентности организма к альтерирующим влияниям
и увеличению продолжительн ности активной фазы витального цикла. Известно, что
вдох и задержка дыхания на вдохе активирует симпатическую нервную систему, а
выдох и задержка на выдохе - парасимпатическую. Основным механизмом, посредством
которого реализуется данный биологический эффект, является наличие функциональной
связи деятельности легких со всеми органами системами организма, учитывая важность
насыщения кислородом крови всех клеток (за исключением небольшого числа высокоспециализированных
соединительнотканных элементов).
Если рассматривать вектора взаимодействия легких, то прежде
всего следует выделить несколько основных групп:
1. Структурно-физиологическое обеспечение:
а) деятельность сердечно-сосудистой системы (сердце и сосудистый]
коллектор), костно-мышечный каркас (межреберные мышцы, диафрагма и
нервные центры, обеспечивающие экспираторное и инспираторное дыхание);
б) органы кроветворения, в частности, эритропоэз (красный костный)
мозг и очаги экстрамодулярного кроветворения);
в)кожа со всеми ее производными.
2. Трофическое и метаболическое обеспечение:
а) кишечник, поджелудочная железа и печень, опорно-мышечный каркас;
б) водно-солевой гомеостаз (надпочечники, элементы соединительной ткани).
3. Нейро-регуляторное обеспечение:
а) стволовая часть мозга (дыхательный и сердечно-сосудистый центры), гипоталамус,
кора головного мозга;
б) эндокринные органы (щитовидная железа, надпочечник, половые железы, паращитовидная
железа и др.).
4.Органы и ткани иммунной защиты (тимус, костный мозг, селезенка
и лимфоузлы).
Одним из важнейших вопросов при выборе тактики и идеологии
лечения является выбор соответствующей методики упражнений, не усугубляющей
течение основного или сопутствующего патологического процесса. Второй вопрос,
который должен решить консультант - выбор метода (техники) дыхательных упражнений,
позволяющий мягко и постепенно наращивать тренирующий эффект "гипоксического"
или "гиперкапнического" синдрома. В связи с этим, упражнения, связанные
с искусственно вызываемыми явлениями гипоксии или гиперкапнии, направлены соответственно,
прежде всего на снижение порога возбудимости хеморецепторов. Во второй фазе
происходит изменение биохимических процессов, направленных на перестройку клеточного
метаболизма таким образом, чтобы максимально реутилизировать углекислый газ.
И в третьей фазе - отмечается развитие т. н. "альтернативной" энергетики
(альтернативной по отношению к аэробной части энергообеспечения), когда активируется
не только анаэробная часть образования макроэргов, но и максимально вовлекаются
в процесс поддержания жизнедеятельности клеток прежде всего жиры и жирные кислоты,
углеводы и аминокислоты. Нельзя исключить также и активацию внутриклеточного
образования молекулярных и активных форм кислорода в результате различных процессов
перекисного окисления для поддержания жизненно необходимой аэробной фазы энергообеспечения,
особенно в органах и тканях с выраженным кислородзависимым образованием АТФ.
По нашему мнению, наиболее адекватным и информативным методом
диагностики начальных адаптивных признаков в процессе дыхательных упражнений
является функциональный кардиотокографический спектральный анализ.
Среди множества методических подходов нами был выбран метод
спектрального анализа кардиотокограмм (А. Н. Флейшман, 1996) и, в частности
- медленных колебаний (МКГ), позволяющий обнаружить наиболее ранние отклонения
в регуляции деятельности не только сердечнососудистой системы, но и других органов
и тканей. При изучении РЭГ БОС-тренинга на физическую работоспособность автор
показал, что двадцатисекундные (VLF) колебания кардиоритма (0.002-0.05 Гц) сохраняли
высокий уровень у лиц повышавших работоспособность, который сочетался с увеличением
анаэробного порога (VCO2/VO2). При ВЭМ-нагрузке у исследуемых регистрировали
потребление кислорода и выделения СО2. Точка пересечения двух кривых коррелировала
с началом аккумуляции лактата крови или анаэробного порога (Флейшман А. Н.,
В. А. Дьячков, 1993). Таким образом была установлена связь между 20- 30 секундными
колебаниями кардиоритма (VLF), уровнем потребления кислорода и работоспособностью.
МЕДЛЕННЫЕ РИТМЫ КАК ОТРАЖЕНИЕ МЕЖСИСТЕМНЫХ РЕГУЛЯЦИЙ
Родоначальник кибернетики Н. Винер указывал, что на современном
этапе развития главные проблемы биологии и медицины должны быть связаны с системами
и их организации во времени и пространстве. Только благодаря эффектам взаимодействия,
биофизические и биохимические процессы могут организоваться в те функциональные
системы, которые необходимы для поддержания гомеостаза и реагирования организма
на различные воздействия. То есть, физиологические свойства, возникающие на
клеточном, тканевом, органном уровнях в результате их взаимодействия приобретают
качества, которые поддерживают то или иное функционирование организма. Усиление
или ослабление взаимодействий в результате вызывает изменение функционального
состояния организма. Энергия медленных колебательных процессов гемодинамики,
в частности, кардиоинтервалов измеряется в еденицах спектральной плотности мощности
(СПМ) = сек. кв. / Гц х 100 баллов.
Ультрадианные ритмы характеризуют деятельность регуляторных
механизмов, обеспечивающих взаимодействие различных систем внутри организма.
Одним из наиболее известных циклов является 90-минутный ритм, отражающий чередование
циклов "покой-активность", фаз медленного и быстрого сна.
Еще в 70 годы Баевским Р. М. была видвинута гипотеза о связи
колебательных процессов в организме с деятельностью различных уровней системы
управления физиологическими функциями, согласно которой, чем длиннее период
колебаний, тем с более высоким уровнем управления они связаны. Ранее Баевским
(1984) было показано наличие различных волн регистрируемых при анализе сердечного
ритма:
волны 1 порядка - сердечные,
волны 2 порядка - дыхательные,
волны 3 порядка - альфа волны 3-6 в мин,
волны 4 порядка - бетта волны 1-2 в мин,
волны 5 порядка- гамма волны 1-8 в час.
Параллельное изучение влияния гормонов коры надпочечника показало,
что фаза действия адреналина составляет -- 6.7 мин, норадреналина -7.7 мин,
17-ОКС - 9 мин, гипофиз-надпочечник - 100 мин. Согласно его мнению, деятельность
любого контура управления включает три этапа: 1 - сбор информации о состоянии
управляемых процессов.(афферентный процесс), 2 - обработка получаемой информации
и выработку решения (афферентный синтез), и 3 - - передачу сигналов управления
в объект управления (эфферентный процесс). Чем больше элементов - объектов управления
входит в контур регулирования, тем больше длится процесс сбора информации, афферентного
синтеза и передачи управляющих сигналов. Следовательно, чем больше период биологического
ритма, тем с большим числом объектов управления связан соответствующий уровень
(контур) управления.
Эксперимент проводился в ходе 5 длительных космических экспедиций
на орбитальной станции МИР у 11 космонавтов. Согласно полученным данным в ходе
космического полета наблюдается последовательная активация все более длинных
периодов ультрадианного диапазона - на 2-3 месяце полета наблюдается значительное
усиление колебательных процессов с периодами от минут до нескольких десятков
минут, а у одного из них наблюдалась активация колебаний с периодом в 3-4 часа.
Следует учесть, что именно на 2-3 месяце наблюдается относительная устойчивость
адаптации человека к условиям невесомости, когда преобладание 90-минутной составляющей
ритма заменяется 3-4 часовым периодом колебаний. Значительно удлинняется базовый
фон динамики частоты пульса во время сна. Характер этих ритмов свидетельствует
о том, что связаны они с деятельностью высших вегетативных центров, включая
гипофизарно-гипоталямический комплекс.
Работы Кринского В. И. и Иваницкого Г. Р. (1982-1985) по теории
автоколебательных процессов в сердечно-сосудистой системе дают веские основания
предполагать, что МКГ имеют автоколебательную природу и тесно сопряжены с медленными
колебаниями тканевого метаболизма, и с другой - с системами регулирующими этот
метаболизм. Спектральный анализ гемодинамической информации проводился на основе
алгоритмов, описанных в литературе (Марпл мл. С. Л., 1990). Используя сравнительный
анализ параметрических и непараметрических методов цифрового спектрального аданализа
с равномерным окном. Диапазон которых лежал в пределах: первого 0.004-0.08 Гц,
ранее обозначаемый как низкочастотный, сейчас как очень низкочастотный (VLF).
Второй диапазон - десятисекундный ритм 0.09-0.17 Гц - ранее среднечастотный,
сейчас как низкочастотный (LF). Третий диапазон остался такой же и обозначался
как высокочастотный 0.17-0.05 (HF).
Согласно автору, методика включает пятиступенчатый тест: регистрация
исходного фона в течение 264 сердечных циклов, стресс-тест в виде умственного
счета путем вычитания 500 - минус 7, первого восстановительного периода, регистрируемого
через 5-7 минут, гипервентиляционной нагрузки за этот же период, и второго восстановительного
периода через 5-7 минут.
Современные представления о биоэнергетике были заложены работами
Е. Lipmann (1941), В, А. Энгельгарда и М. Н. Любимовой (1942), показавших роль
АТФ, как источника энергии для совершения биохимической работы. Было показано,
что метаболические процессы отличаются периодическими изменениями или колебаниями.
В частности колебания на молекулярном уровне характерны для многих ферментативных
реакций, в том числе и для расщепления глюкозы с образованием АТФ, равной 2-3
минутам (A. Boiteux, В. Hess et all. 1977). Нарушение этих процессов, по мнению
авторов, ведет к недостаточности синтеза АТФ, а следовательно к метаболическому
энергодефициту. Между биохимическими и биофизическими колебательными изменениями
в тканях существует несомненная связь (В. Б. Гречин, 1977).
Дефицит тканевого метаболизма на организменном уровне может
протекать при различном медленно волновом сосудистом оформлении. Вместе с тем,
уровень медленных волновых процессов гемодинамики (депрессия, гиперэнергетические
состояния) указывают на степень мобилизации адаптивных процессов в различных
системах организма. Например, компенсированное усиление деятельности ЦНС, ее
нейроэндокринной функции наблюдается при недостаточности периферического гормонального
звена в половых гормонах при климаксе, при посткастрационном синдроме. Выраженность
метаболических изменений при чрезмерно усиленных МКГ может быть значительна
в нейроэндокринологии и онкологической практике.
Опыт пятилетней работы, проведенный в лаборатории А. Н. Флейшмана,
показал, что некоторые спектральные характеристики указывают на прямой тканевой
метаболический, в других случаях изменения МКГ формируются под воздействием
нарушенной регуляции метаболизма (нейрогенной, эндокринной). Высокая степень
совпадения волновой депрессии с депрессией метаболических процессов в тканях
дает возможность использовать спектральные исследования для патогенетической
терапии энергодефицита. Рис. 1.
Используемая в проводимой научно-исследовательской работе
техническая аппаратура (интерфейс, компьютерная программа) и методика позволяют
провести анализ медленных колебательных процессов кардиоритма в диапазоне частот
от 0,02 Гц до 0,5 Гц три волновых характеристики (Флейшман А. Н., 1994). Первый
волновой показатель выделяется в диапазоне 0,02-0,08 Гц и соответствует 20 сек.
ритмам. Мощность и частота этой волны указывает на активность гуморально-метаболических
механизмов регуляции с доминированием центральной и симпатической регуляции.
Второй волновой показатель, выделяемый в диапазоне 0,09 - 0,16 Гц, соответствует
10 сек. ритмам. Мощность и частота этой волны указывает на симпатическую активность
с привлечением активности ренинангиотензиновой системы и барорегуляторных сдвигов.
Третий волновой показатель выделяется в диапазоне частот от 0,17-0,5 Гц соответствует
3,5 сек. ритмам. Мощность и частота этой волны соответствует парасимпатической
регуляции.
Все три показателя отражают биоэлектрическую активность метаболических
процессов, сопряженных с информационно-управляющими и энергетическими функциями
организма. Энергетическая компонента представляет совокупность элементов организма
(структурная, функциональная), которая преобразует энергетическое вещество в
энергию. Информационная компонента связана с управлением энергетическими процессами
и реализует хранение, переработку и использование информации. Регистрируемые
ритмы являются составной частью этих двух компонентов. Обе составляющие компоненты
тесно связаны между собой и обеспечивают поддержание целостности организма и
сохранение стационарного неравновесного состояния всех подсистем.
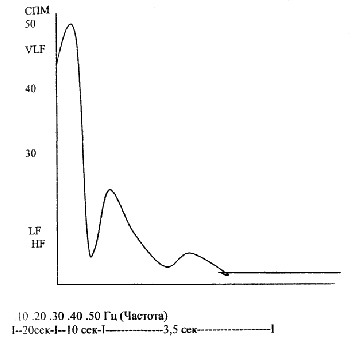
Рис. 1. VLF - эрготропные реакции, допустимый диапазон значений спектральной
мощности (СПМ) равен 30 -130 (+- 5%): а) 0-25 понижение СПМ, б) 25-160 средний
уровень СПМ, в) 360 - 1000 и выше высокий уровень СПМ.
LF - отражает изменения барохеморецепции (диапазон СПМ 0-25), HF - трофотропные
процессы (диапазон СПМ - 0-25 +-5%)
Таким образом, совокупность возможных ответных реакций сердечнососудистой
системы (целостного организма) с участием нейро-гормональных и метаболических
процессов на спектрограмме регистрируется в виде трех пиков 20, 10 и 3,5 сек.
ритмов, которые отражают суммарное состояние центрального и периферического
контура регуляции, соотношение симпатического и парасимпатического отделов,
эрго- и трофотропных процессов, барорегуляторные сдвиги. При этом учитывается,
что показатели спектрограмм сами по себе не отражают функционирование механизмов
управления, энергообразования, а лишь обозначают первоначальные и конечные (промежуточные)
их динамические состояния в виде мощности амплитуды колебания. При этом частные
механизмы, обеспечивающие регистрируемые процессы, только предполагаются и могут
быть уточнены другими методами исследования.
Показатели спектрограммы объединяет временное взаимодействие
динамического состояния регулирующих механизмов и субстратов реагирования независимо
от их места нахождения (ткани, органы, системы). Следовательно, на спектрограмме
регистрируются не сами субстраты реагирования, а результаты (мощность-вектор)
интегральных реакций между ними в виде эрго-, трофотропных и барорецептивных
показателей. Поэтому показатели спектрограмм можно рассматривать, как происходящие
взаимодействия между различными субстратами реагирования и регулирующими механизмами.
Гулик В. Ф., Флейшман А. Н. и др. (1997) показали, что изменения энергетических
процессов в миокарде предшествуют снижению его сократительной активности и развитию
гемодинамических сдвигов. При этом информационные процессы в сердечно-сосудистой
системе, включая нервную и гуморальную регуляцию, изменяются раньше, чем выявляются
гемодинамические, метаболические и энергетические нарушения. По мнению авторов,
в целостном организме система кровообращения выполняет функцию согласующего
звена между управляющими и управляемыми звеньями. При этом кардиоритм отражает
законченный цикл сердечной деятельности и является носителем информации гуморально-гормональной
регуляции, обмена энергии, метаболизма и в конечном итоге, об адаптационно-приспособительных
процессах. В условиях изучения и разделения целостного организма, как сложной
биологической системы, на составляющие его элементы, как правило, исчезают эффекты
взаимодействия, в результате чего теряется свойство целого, которое и определяет
его функциональное состояние, реактивность, ритмичность, способность приспосабливаться
к изменяющимся условиям внешней среды, способность компенсировать поврежденные
функции органов и тканей.
При анализе и обсуждении показателей МКП гемодинамики учитывались
следующие положения об основных принципах функционирования организма по А. Н.
Флейшману (1999):
1. Целостный организм не является простой суммой физиологических
систем органов.
2. Целостный организм представляет единую функциональную систему.
3. Процессы саморегуляции, самоконтроля и самоуправления объединяют
клетки, органы и системы в единое целое.
4. В процессе жизнедеятельности уровень функционирования организма
подвергается непрерывной перенастройке внутренних связей между физиологическими
системами, отражающиеся в изменении их активности и регулирования.
5. Наличие постоянных флюктуации функциональных показателей - это
закономерное явление в живых системах (Э. Бауэр, 1935). Флюктуации являются
ведущим принципом функциональной организации организма, принципом устойчивого
неравновесия.
6. Уровень функционирования физиологической системы определяется
наличием относительно стабильной величины специфических реакций, обусловленных
природой раздражителя и свойствами самой системы.
7. Каждая из физиологических систем, обладая собственным уровнем
функционирования, участвует в поддержании гомеостаза и обеспечении адаптационно-приспособительной
деятельности.
8. Адаптация и гомеостаз - это два конечных результата, которые
организуют соответствующие функциональные системы. Они являются основными системообразующими
факторами.
9. Ритмичность (цикличность) является одним из системообразующих
свойств ррганизма, обеспечивающих временную согласованность физиологических
процессов.
10. Взаимодействие управляющих механизмов влияет на уровень функционирования
физиологических систем. Они изменяют интенсивность энергетических, информациионных
и метаболических процессов и, следовательно, изменяют интенсивность функции
соответствующей структуры.
11. Конечный эффект регулирующих и приспособительных реакций зависит
от взаимодействия ряда переменных условий: а) физиологических свойств организма,
б) исходного функционального состояния, в) неспецифической устойчивости организма.
ВЫСОКИЙ УРОВЕНЬ
Избыточный ответ адаптационной системы на стресс при возрастных
изменениях в гомеостазе В. Н. Дильман (1987) обозначил как гиперадаптоз. Характеризующийся
высо-ким синтезом кортикостерона в крови и изменениями в гипоталамо-гипофизарной
системе гиперадаптоз увеличивает частоту послеоперационных изменений у онкологичес-ких
больных, приводит к уменьшению жизнеспособности организма.
Усиление VLF может наблюдаться при первичных поражениях ствола мозга,
при нарушении метаболизма - панкреатиты, гепатиты и пр., при развитии тренированности
к гипоксии (усиление глюконеогенеза). Кроме того, повышение VLF является важным
критерием развития адаптивных изменений при проведении дыхательных упражнений
с гипоксическим вектором. При этом иногда отмечается брадикардия при повышенном
или нормальном АД, отсутствие изменений или тахикардия с неустойчивым АД. Повышение
20-минут ритмов происходит при облучении, лечении гормональными препаратами
(прогестероном, Л-тиреоидином, витаминами и энергетическими смесями). При беременности,
гиперадаптивное состояние может привести к стремительным родам, дискоординации
родовой деятельности или ее отсутствии, повышении АД и утраты ваго-инсулярного
комплекса.
Следует отметить, что гиперадаптоз (1000 и более единиц), сопровождающийся
повышением барорецептивной или вагоинсулярной активности, сочетается с брадикардией,
умеренным повышение АД в 40% случаев, активацией фагоцитарной активности, нарушением
деятельности щитовидной железы, повышением концентрации кортикостероидов. Жалобы
могут отсутствовать или характеризоваться разнообразным астеническим функциональным
состоянием напряжения ВСД, неврастенией, гиперплазией щитовидной железы, гипоталямическим
синдромом, ожирением.
Источником нарушений при этом, как правило, являются первичные и
вторичные гипоталямические нарушения, посткастрационный синдром и климакс. Гиперактивность
может подавляться - психотерапией, иглорефлексотерапией, психотропными препаратами
седативного действия, токолитиками (партусистеном, атропином) и наркозом.
СРЕДНИЙ УРОВЕНЬ
Средние показатели КГМ характеризуются рядом клинических
состояний: 1 группа. Доминирование 10 сек. интервалов. Нарушение нейровегетативного
профиля, может проявиться в исходном состоянии при нагрузке или при восстановлении.
При беременности это наблюдается, как правило, при фетоплацентарной недостаточности,
выкидышем, преждевременными родами или мертворождением. Иногда болями в низу
живота, шевелением плода и др. Наблюдается при утомлении, нарушении ССС, ее
барорецептивных функций. У беременных аналогичные изменения могут происходить
со стороны матери или со стороны маточноплацентарного кровообращения. Со стороны
матери - это сопровождается жалобами на утомляемость, сонливость, тахикардию.
В анамнезе до беременности констатируется вегето-сосудистая дистония, эндокринные
сдвиги. Во втором случае жалобы отсутствуют и изменения происходят со стороны
плода: брадикардия, глухость тонов, обвитие пуповины или частичная отслойка
плаценты, кровотечение.
2 группа. Низкие показатели вагоинсулярных процессов или трофотропных
функций. Нередко сочетается с низкими эрготропными функциями и тахикардией.
Чаще всего это сопровождается низкой гормональной активностью, низкими резервами
и плохим прогнозом в плане обеспечения жизненных процессов у плода.
3 группа. Преобладание вагоинсулярных процессов.
4 группа. Дистонический тип. Гормонально-вегетативная неустойчивость,
сопровождающаяся резкой сменой уровня эрготропных и вагоинсулярных процессов,
выраженным гипервентиляционным эффектом, высоким пиком 0.2 Гц с последущим падением
эрготропных функций в стадии восстановления.
5 группа. Характеризуется повышением матаболической и вегетативной
активности, когда все приподнято, при естественной гормональной активности у
молодых людей в 20-25 лет, при введении в организм лекарств, обладающих стимулирующей
активностью гормонально-метаболических систем, при гиперплазии щитовидной железы
с избыточной ее активностью. Этот тип реакции относится к пограничным, так как
при стрессовых нагрузках или функциональных пробах он переходит в гиперадаптивный
процесс. Подобный фон характерен для лиц с высоким риском развития гипертонического
криза.
НИЗКИЙ УРОВЕНЬ
Уменьшение основной энергии взаимодействий в организме замечено
при принятии пищи. К этому ведут многие процессы в организме, связанные с интоксикацией,
гипоксией, авитаминозом, гепатитом, циррозом печени, сопровождаются разобщением
взаимосвязи между системами, нарушением метаболических реакций и появлением
энергодефицита.
Гипоадаптивнее состояние (ниже 25 баллов) отличается низкой
реактивностью, постнагрузочным сниженим колебаний, практически, нулевым значением
вагоинсулярного комплекса, тахикардией до 88-105 уд/мин, повышением АД в 85%
случаев, иммуноде-фицитным синдромом, нарушением липидного и белкового обмена,
ферментативных процессов, тканевого дыхания, значительными колебаниями содержания
кортизола в крови. Клинически при этом выявляется - выраженная слабость, утомляемость,
снижение физической работоспособности, одышка, большое число соматических жалоб.
Наличие диагноза - хронический гепатит, панкреатит, гипертоническая болезнь
11 ст., нефрит, аутоиммунный тиреоидит (в стадии декомпенсации). Источником
изменений является, в основном, - первичное угнетение тканевого метаболизма,
полиорганная недостаточность (печени, поджелудочной железы, почки и др.), поражение
ЦНС - коры, подкорки с преобладанием угнетения, или активации стволовой части
ЦНС.
Процессы энергодефицита наблюдаются при: а - первичном уменьшении
свободной энергии, при иммуноконфликте, эндогенной интоксикации, связанной с
распадом тканей (инфаркт миокарда, распад опухоли, первичная тканевая гипоксия),
б - вторичных регуляторных нарушениях при изменении в ЦНС (корковых, подкорковых,
стволовых в гипоталамической области, в эрго- и трофотропных зонах), при стрессе
и болях, в -нейроэндокринных нарушениях, изменениях и заболеваниях желез внутренней
секреции (аутоиммунный тиреоидит, посткастрационный синдром и т. д.), г - выраженных
нарушениях метаболизма печени (цирроз) и поджелудочной железы (панкреатит).
При выявлении таких состояний изменения на кардиоспектрограммах
могут появиться при функциональных пробах или в исходном состоянии при скрытых
патологических процессах в доклинической форме.
Истощение симпатоадреналовой системы наблюдается при нагрузках
в двух уровнях: 1) гиперактивация экскреции адреналина и норадреналина, что
резко снижает запасы допамина и ДОФА, 2) гипоактивация (истинное истощение)
симпатоадреналовой системы и ее резервов. Авторы предлагают лечение этой патологии
малыми дозами Л-ДОФА (0.5 гр в день в течение 5-7 дней).
Реакция здорового организма на функциональные пробы после
нагрузок характеризуются следующими изменениями: счет в уме - снижение 20 сек.
и повышение 3.5 сек. ритмов в 70%, у 30% пациентов выявляется обратная зависимость,
свидетельствующая о наличии стресса. Гипервентиляция - так же как и при счете.
Появление доминирующего пика в области барорецепторной зоны отмечено при центра-льных
вегетативных дисфункциях - утомлении, депривации сна, трансмеридианных перелетах,
нередко сопровождающиеся снижением энергетики спектра, доминированием и усилением
10 сек. ритмов. Холодовая кистевая проба: в момент воздействия - снижение 3.5
сек. ритмов, учащение пульса и подъем давления, в восстановительном периоде
- повышение 20 и 10 сек. ритмов.
Таким образом, используя данные кардиоспектротокографического
анализа можно довольно точно оценивать исходное состояние пациента для индивидуального
подбора режимов аппаратного дыхания, контролирования эффективности проводимых
тренировок и адекватного определения динамики и времени, увеличения или уменьшения
нагрузок. Специально следует отметить, что МКГ позволяет своевременно выявить
дизадаптивные, стрессовые и патологические изменения в организме, возникающие
при неадекватной или нарушенной технологии проведения дыхательных упражнений.
СПИСОК ОСНОВНЫХ ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ
Баевский Р. М. Временнная организация функций и адаптационно-приспособитель-ная
деятельность организма. В кн.: Теоретические и прикладные аспекты анализа временной
организации биосистемы.- М., Наука., 1976, с. 88-101.
Баевский Р. М. Прогнозирование состояний на грани нормы и патологии.-
М, "Медицина", 1979, 295 с.
Баевский Р. М., Кеннер Т., Мозер М., Фунтова И. И., Черникова А. Г. Медленные
колебания сердечного ритма в ночной период суток в условиях длительного космического
полета. В тр. симпозиума: Медленные колебательные процессы в организме человека:
теория; практическое применение в клинической медицине и профилактике. Новокузнецк.
1977. Стр. 8-13 .
Баевский Р. М., Киррилов О. И., Клецкин С. 3. Математический анализ изменений
сердечного ритма при стрессе.- М. "Наука", 1984. 221 с.
Беллер Н. Н. Висцеральное поле лимбической коры: Организация эфферентной
функции.- Л.: "Наука", 1977. 160с.
Бобков А. Г. Морфология дыхательной системы. В кн: Болезни органов дыхания.
Руководство для врачей. Ред. Н. Р. Палеев.- М. "Медицина", 1989. Стр.
9-31.
Бобков А. Г. Патоморфология и патогенез неспецифических заболеваний легких.
В кн: Болезни органов дыхания. Руководство для врачей. Ред. Н. Р. Палеев.- М.
"Медицина", 1989. Стр. 32-48.
Бреслав И. С, Глебовский В. Д. Регуляция дыхания. - Л.: Наука, 1981.280
с.
Войно-Ясинецкий А. В. Отражение эволюционных закономерностей в эпилептиформной
реакции животного на действие высокого парциального давления кислорода. Изд.
АН СССР.- М.- Л. 1958.
Гембицкая Т. Е. Роль наследственных факторов в легочной патологии. В
кн: Болезни органов дыхания. Руководство для врачей. Ред. Н. Р. Палеев.- М.
"Медицина", 1989. Стр. 230-239.
Гулик В. Ф., Флейшман А. Н., Слепушкин В. Д., Неретин К. Н., Майнагашев С.
С., Голощапов А. А. Обоснование использования характеристики медленных колебательных
процессов гемодинамики (МКП) для оценки текущего функционального состояния организма
беременной и роженицы. В тр. симп. "Медленные колебательные процессы в
организме человека: теория, практическое применение в клинической медицине и
профилактике". Новокузнецк. 1997. Стр. 60-63.
Жихарев С. С. Физиологические и патофизиологические механизмы проходимости
бронхов.-Л. 1984. С. 195-197.
Захаржевский В. Б. Нервный контроль коронарного кровообращения: участие
кортикальных механизмов в регуляции кровоснабжения сердечной мышцы.- Л. "Наука",
1979. 173 с.
Захаржевский В. Б. Экспериментальные неврозы. В кн.: Физиология кровообращения.
Регуляция кровообращения. (Руководство по физиологии). Изд. "Наука".-Л.
1986. Стр. 526-546
Иваницкий Г. Р., Кринский В. И. Автоволновые процессы: общие закономерности
биологических, химических и физических активных сред. Препринт. Пущине. 1982.
Илюхина В. А. Нейрофизиология функциональных состояний человека.-Л.,
1986.
Илюхина В. А., Заболотских И. Б. Энергодефицитные состояния здорового
и больного человека. Спб. 1993.- 192 с.
Клемент Р. Ф. Физиологические механизмы внешнего дыхания и их нарушения.
В кн: Болезни органов дыхания. Руководство для врачей. Ред. Н. Р. Палеев - М.
"Медицина", 1989. Стр. 49-70.
Кокосов А. Н. Общеклинические лабораторные методы исследования. 1989.
Стр.257-260.
Лапин Б. А., Черкович Г. М., Яковлева Л. А. Экспериментальное воспроизведение
на обезьянах заболеваний сердечно-сосудистой системы. Вестн. АМН СССР. 1966,
№ 4, с. 73-81
Марпл-мл. С. Л. Цифровой спектральный анализ и его приложения.- М. Мир.
1990
Общая пульмонология. Ред. Н. В. Путова. Москва."Медицина", 1989.
Плужников М. С., Рязанцев С. В. Роль верхних дыхательных путей в физиологии
и патологии бронхолегочной системы. В кн: Болезни органов дыхания. Руководство
для врачей. Ред. Н. Р. Палеев.- М. "Медицина", 1989. Стр. 101-111.
Поляков В. В., Ерков В. П. Роль физических и химических факторов в этиологии
и патогенезе заболеваний легких. В кн: Болезни органов дыхания. Руководство
для врачей. Ред. Н. Р. Палеев.- М. "Медицина", 1989. Стр. 224-229,
Проссер Л., Браун Ф. Сравнительная физиология животных. Изд. "Мир"
М. 1967.
Путов Н. В., Егурнов Н. И. Легочное кровообращение в норме и патологии.
В кн: Болезни органов дыхания. Руководство для врачей. Ред. Н. Р. Палеев.-М.
"Медицина", 1989. Стр. 177-192.
Райскин М. Е., Онищенко Н. А., Шаргородский Б. М. и др. Методы прижизненного
исследования метаболизма сердца.- М. "Медицина", 1970.264с.
Репин Ю. М., Старцев В. Г. Механизмы избирательного поражения сердечно-сосудистой
системы при психоэмоциональном стрессе. Вестн. АМН СССР. 1975, № 8, с. 71-76
Суворов Н. Ф. Центральные механизмы сосудистых нарушений.- Л. "Наука",
1967,244с.
Сыромятникова Н. В., Гончарова В. А. Нереспираторные функции легких. В кн: Болезни
органов дыхания. Руководство для врачей. Ред. Н. Р. Палеев.- М. "Медицина",
1989. Стр. 193-201.
Токин Б. П. Общая эмбриология. Изд. Ленинградского университета. Ленинград.
1967. 456 с.
Федосеев Г. Б., Жихарев С. С. Основные механизмы защиты бронхолегочной
системы. В кн: Болезни органов дыхания. Руководство для врачей. Ред. Н. Р. Палеев.-
М. "Медицина", 1989. Стр. 112-143.
Федосеев Г. Б., Синицына Т. М. Роль биологических ритмов в патогенезе
заболеваний легких. Там же. Стр. 240-246.
Федосеев Г. Б., Трофимов В. И. Регуляция бронхиальной проходимости в
норме и патологии. Там же. Стр. 157-175.
Флейшман А. Н. Теоритические и методические проблемы анализа медленных
колебаний гемодинамики. Классификация энергоизмененных состояний. В тр. симп.
"Медленные колебательные процессы в организме человека: теория, практическое
применение в клинической медицине и профилактике". Новокузнецк. 1997. Стр.
14-42.
Флейшман А. Н. Классификация спектральных показателей медленных колебаний
гемодинамики - основа прогноза, патогенетической терапии и оценки функционального
состояния человека.Там же. Стр. 24-42.
Шик Л. Л. Регуляция дыхания. В кн: Болезни органов дыхания. Руководство
для врачей. Ред. Н. Р. Палеев.- М. "Медицина", 1989. Стр. 70-85.
Щелкунов В. С. Дыхательная недостаточность. Там же. Стр. 85-100.
Наш
сайт является помещением библиотеки. На основании Федерального
закона Российской федерации
"Об авторском и смежных правах" (в ред. Федеральных законов от 19.07.1995
N 110-ФЗ, от 20.07.2004
N 72-ФЗ) копирование, сохранение на жестком диске или иной способ сохранения
произведений
размещенных на данной библиотеке категорически запрешен.
Все материалы представлены исключительно в ознакомительных целях.
|
|
Copyright © UniversalInternetLibrary.ru - электронные книги бесплатно

